2011药士执业考试-生物化学氨基酸的性质(3)
2011-04-12 08:41阅读: 来源:爱爱医责任编辑:爱医培训
[导读] 针对2011年执业药士资格考试最新大纲要求,对生物化学教科书中与氨基酸的性质有关的重点难点考点重新整理归纳总结
3、氨基酸的立体化学
⑴蛋白质中的氨基酸有些是右旋(+),有些是左旋(-),只有Gly无旋光性。
偏振光通过尼可尔棱镜,能使偏振光的偏振面向左或向右旋转。
⑵蛋白质中存在的所有天然氨基酸都属L型氨基酸,是以L—(D—)甘油醛为参考。
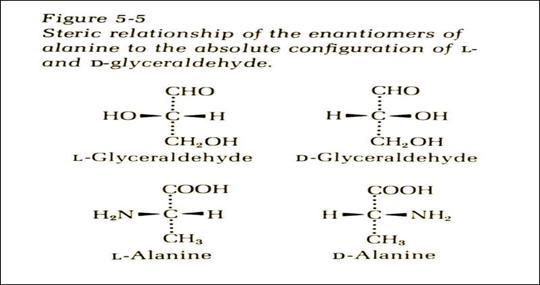
D型的氨基酸在自然界也有,作为A:抗生素的成分;B:微生物细胞壁的成分而存在。
自然界选择了L型氨基酸,D型氨基酸同样可形成有活性的蛋白质(通过化学合成)。
实验室中合成的氨基酸无旋光活性,构型与旋光性无直接对应关系。
见图 L型、D型氨基酸的由来
4、氨基酸的吸收光谱
⑴20种氨基酸都不吸收可见光;
⑵只有酪氨酸、色氨酸、苯丙氨酸吸收紫外光,最大吸收波长分别为275nm、280nm、257nm;
⑶由于蛋白质大多有色氨酸和苯丙氨酸,故蛋白质吸收紫外线最**长在280nm,利用分光光度计测定蛋白质对280nm紫外光的吸收,可测蛋白质含量。
5、氨基酸的重要化学反应
⑴茚三酮反应
见图 茚三酮反应的反应式
弱酸条件下,加热,水合茚三酮与α-AA发生反应,使α-AA脱氨、脱羧,生成还原茚三酮、氨、CO2;
茚三酮与氨和还原茚三酮发生作用,生成蓝紫色产物,只有脯氨酸,羟脯氨酸反应生成黄色化合物。
应用:可以作为氨基酸的比色测定方法,用纸层析或柱层析法把各种AA分开后,利用茚三酮显色可定性和定量测各种AA(CO2可用测压法测量,从而计算出AA的量)。
添加爱医培训微信即可免费获得相关
专业考试题库一套,历年真题、章节
练习题、考试模拟题应有尽有!
手机/微信:17052762074
专业考试题库一套,历年真题、章节
练习题、考试模拟题应有尽有!
手机/微信:17052762074

版权声明:
本网所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系,我们将立即进行删除处理。
本网所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系,我们将立即进行删除处理。
- [广告]在爱医培训报培训班的考生赠送爱医培训vip服务(班主任老师全程指导、量身制定学习计划、学习跟踪、学习督导、专家在线答疑等);赠送爱医培训VIP题库1个。
- 课程名称
- 课程试听
- 报名
-
报班后爱爱医会员可凭kspxg2016代码向客服索要相关专业题库一个。课程开通后另赠送爱医币100.
快速咨询热线:400-626-9910(按2号键)
客服工作 QQ :1834177520
 免费试听
免费试听



